【国自然新热点研究思路】组蛋白修饰
发布时间:2024-10-11
浏览次数:25860
作者:东极药物
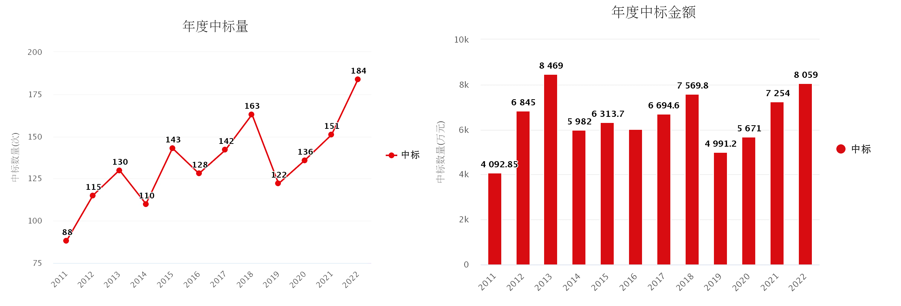
近年来,组蛋白修饰的高质量文章不断涌现,而且近几年国家自然科学基金的资助项目中,组蛋白修饰的项目也在不断增多。从22年的国自然中标情况来看,组蛋白修饰已成为当前生命科学和基础医学研究的一大热点。一、组蛋···
近年来,组蛋白修饰的高质量文章不断涌现,而且近几年国家自然科学基金的资助项目中,组蛋白修饰的项目也在不断增多。从22年的国自然中标情况来看,组蛋白修饰已成为当前生命科学和基础医学研究的一大热点。
一、组蛋白修饰概述
我们都知道,生命遗传信息的载体是染色体,其中DNA、IncRNA、组蛋白修饰都可以调控基因的转录和表达。其中,组蛋白翻译后修饰主要发生在蛋白尾部,其修饰的类型和位点的多样性构成了组蛋白功能的多样性。
01组蛋白的命名
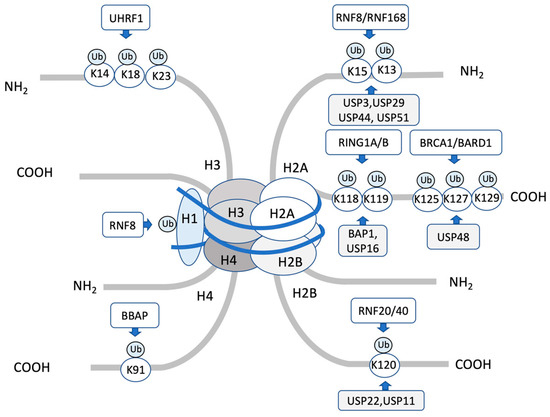
组蛋白主要家族:H1/H5(连接组蛋白)、H2A、H2B、H3、H4
组蛋白氨基酸:K(赖氨酸)、R(精氨酸)
修饰类型:Me(甲基)、P(磷酸盐)、Ac(乙酰基)、Ub(泛素)
例如H3K4me3表示H3连接组蛋白赖氨酸氨基酸第4位三甲基化。
02组蛋白修饰调控酶
Writers:书写器,修饰酶,添加修饰基团
Erasers:擦除器,去修饰酶,去除修饰基团
Readers:阅读器,识别蛋白,识别修饰信息
如果研究涉及组蛋白修饰酶及其复合体鉴定,首先需要评估组蛋白修饰水平(ChIP-seq),然后联合RNA-seq分析其对基因表达的调控,从而形成完整的表观修饰机制证据链。
那么既然存在蛋白修饰调控酶,组蛋白修饰一定能调控基因的转录。组蛋白修饰调控基因转录分为直接调控与间接调控。
直接调控:通过插入修饰,影响核小体-核小体相互作用。
间接调控:组蛋白乙酰转移酶通过转录因子(TFs)募集,或利用其固有的溴结构域结合预先存在的乙酰化赖氨酸残基,并在启动子处强力乙酰化组蛋白。
二、组蛋白修饰类型
组蛋白修饰类型主要分为组蛋白磷酸化、组蛋白甲基化、组蛋白乙酰化和组蛋白泛素化。
01组蛋白磷酸化
组蛋白磷酸化是标记DNA损伤位点是组蛋白修饰的重要环节。如果没有修复标记,DNA就会被太阳紫外线等来源累积的损伤所破坏。其中,γH2AX作为蛋白质MDC1的结合位点,是招募DNA修复的关键蛋白。
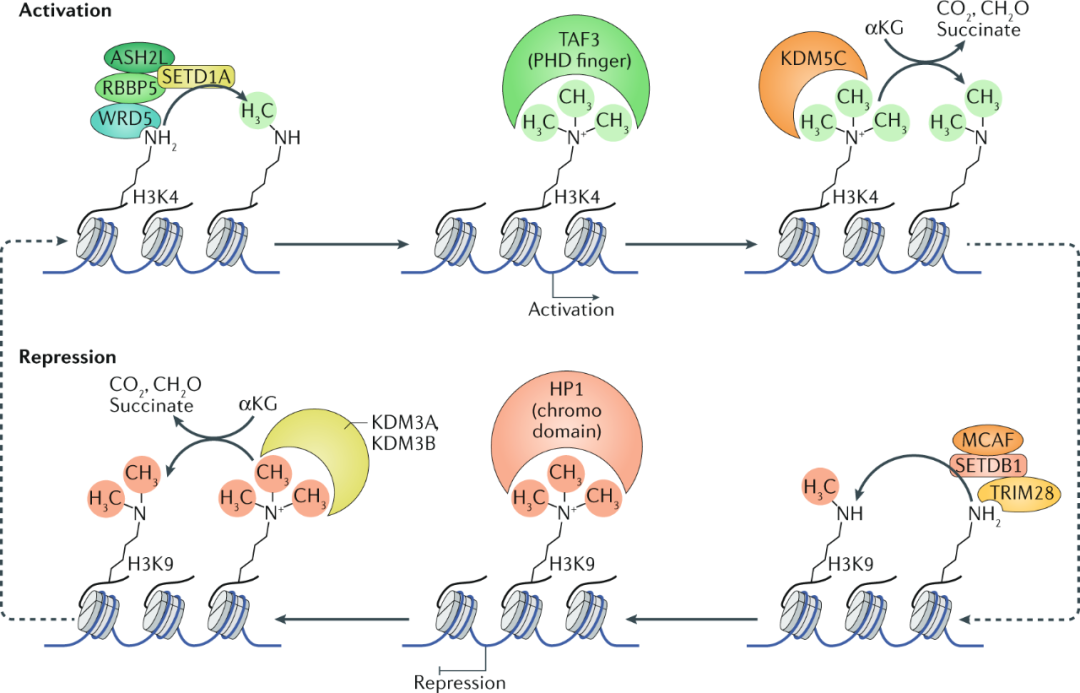
02组蛋白甲基化
组蛋白甲基化修饰包括:
l 两种氨基酸修饰:赖氨酸甲基化、精氨酸甲基化
l 三种状态:单甲基化、二甲基化、三甲基化
l 甲基化调控酶:组蛋白甲基转移酶(HMT)、组蛋白去甲基化酶(HDM)
由于组蛋白甲基化是可逆的,因此需要甲基化调控酶的支撑。
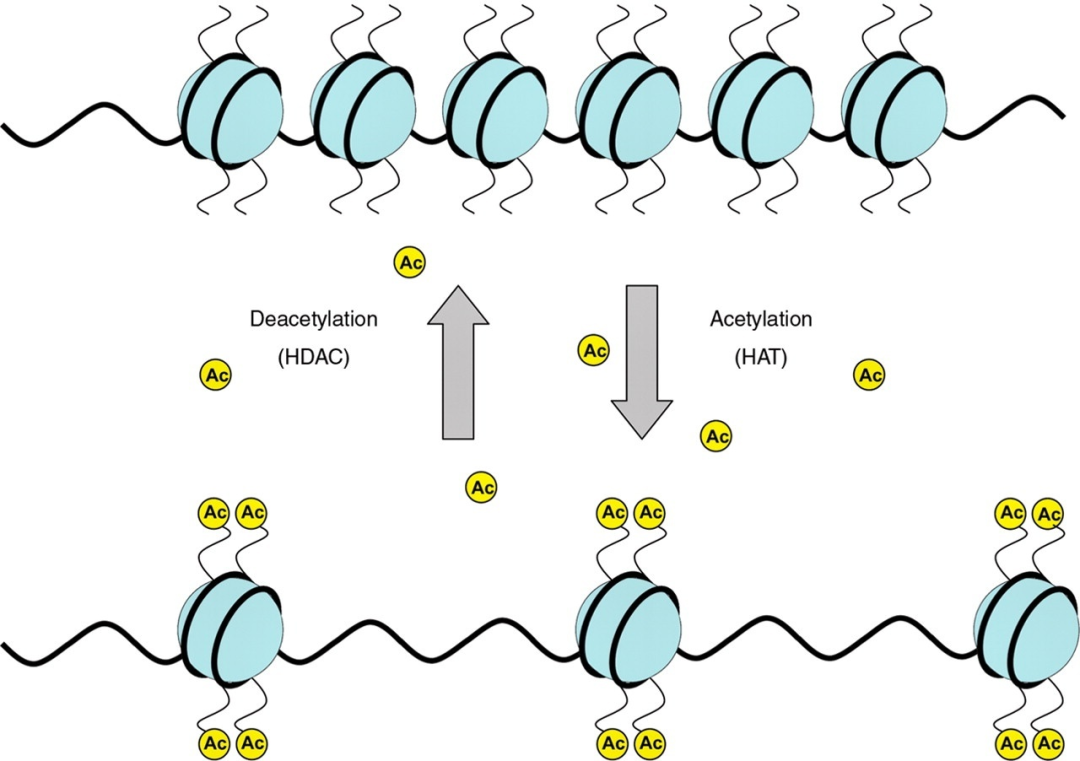
03组蛋白乙酰化
组蛋白乙酰化一般由以下部分组成:
乙酰化阅读器:Bromo结构域、双PHD锌指结构、YEAST结构域。
乙酰化调控酶:组蛋白赖氨酸乙酰转移酶和组蛋白去乙酰化转移酶
研究中一般在细胞内直接纯化目标蛋白后进行质谱鉴定来确定乙酰化位点。
04组蛋白泛素化
蛋白质泛素化是泛素分子的羧基末端与蛋白质的赖氨酸残基结合的过程。泛素化调控酶主要有:泛素激活酶(E1)、泛素结合酶(E2)和泛素蛋白连接酶(E3)。
组蛋白泛素化还会受到许多因素的影响,例如:
细胞中可用的游离泛素,以及组蛋白泛素化酶或去泛素化酶的活性
组蛋白泛素化需要E1、E2、E3等一系列酶作用,而组蛋白去泛素化则需要肽酶作用
三、案例解析
组蛋白修饰研究思路分为以下几种类型:
修饰类型的比较与鉴定,如新型修饰的发现、相同位点不同修饰的竞争、串扰、协同。
现有修饰与机制、代谢结合,如组蛋白修饰与癌症发展机制组蛋白修饰与炎症发生机制。
生物学功能探究。
效应蛋白研究,如新型修饰效应蛋白的挖掘。
相关修饰酶与去修饰酶研究,如修饰酶纯化及鉴定。
案例一:

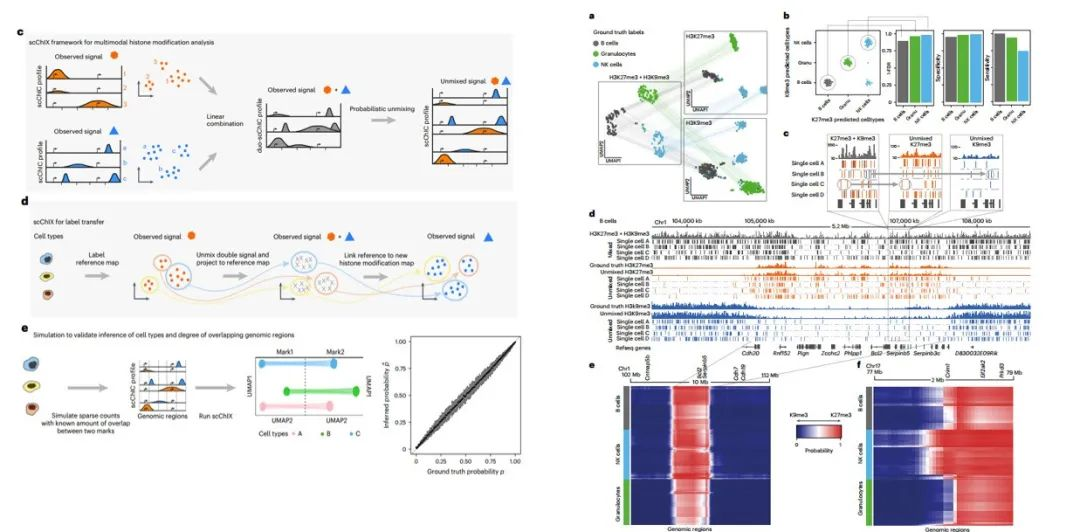
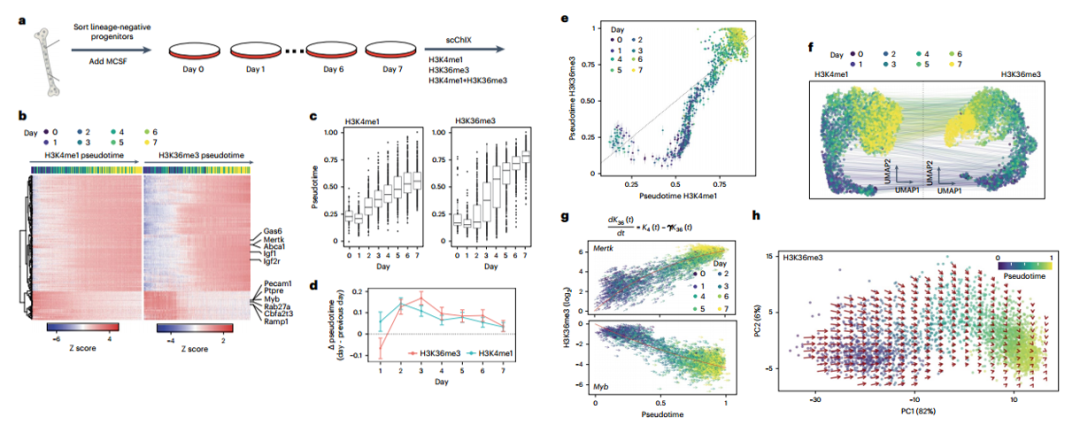
scChIX-seq推断单细胞中组蛋白修饰之间的动态关系
研究背景:动物的基因表达依赖于组蛋白修饰等表观遗传标记来调节基因组在不同细胞类型中的可及性和功能。基于酶系的ChIP-seq替代策略(染色质免疫切割,ChIC)减少了分析表观基因组的背景信号,并使组蛋白修饰的单细胞分析成为可能。当scChIX-seq连接不同组蛋白修饰的单细胞图谱,将揭示单细胞中组蛋白修饰之间的关系,从而解锁单细胞中几种组蛋白修饰的联合分析。
01 Step 1
scChIX-seq可以无偏地为每个标记分配读数,而不考虑基因组中两个标记之间的重叠量,因此作者通过scChIX-seq链接不同组蛋白修饰的单细胞图谱,揭示了单细胞中组蛋白修饰之间的关系。
02 Step 2

为了揭示骨髓中H3K4me1和H3K27me3的关系,作者通过采样小鼠骨髓,将活性染色质(H3K4me1)和抑制性染色质(H3K27me3)整合到细胞中并进行联合分析。
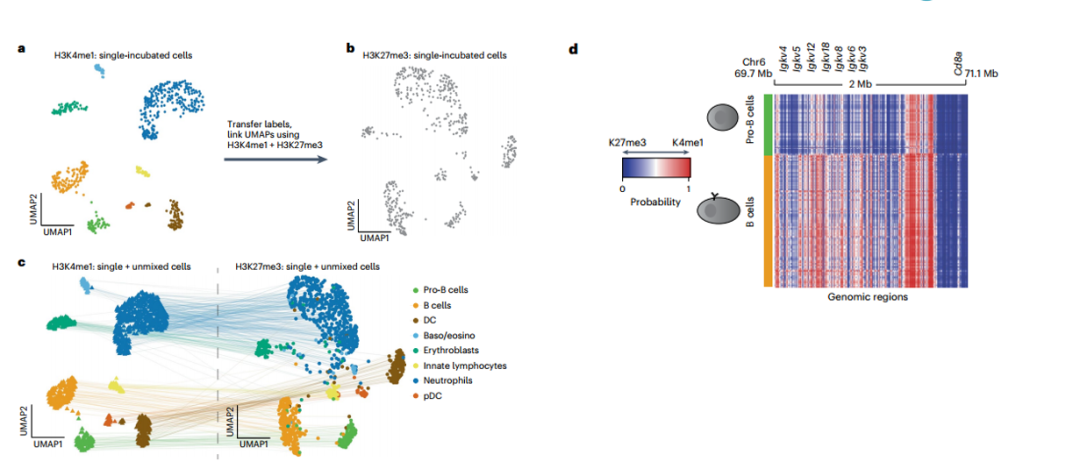
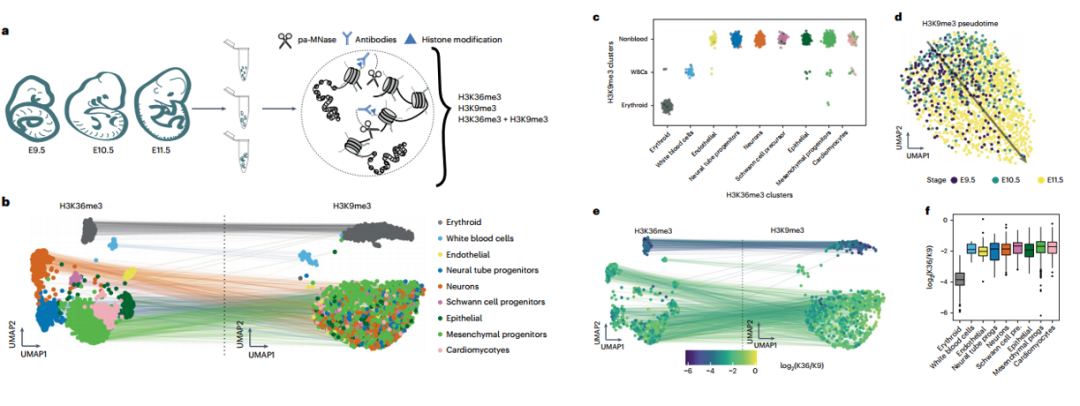
03 Step 3
接着,作者将scChIX-seq应用于小鼠器官,并揭示了H3K36me3和H3K9me3在小鼠器官中发生的差异。
04 Step 4
最后,作者研究了H3K4me1和H3K36me3在体外分化过程中的动态关系。
案例二:

组蛋白乳酰化促进心肌梗塞后修复基因激活
研究背景:心肌梗死(MI)后炎症的消退和心脏修复的启动需要及时激活修复信号。组蛋白乳酸化通过转录调控赋予巨噬细胞稳态基因表达特征。然而,组蛋白乳酸化在心肌梗死后修复反应中的作用尚不清楚。我们的目的是研究组蛋白酰化是否在心肌梗死早期和远端后诱导单核细胞中修复性基因表达。
01 Step 1
作者首先假设心脏募集之前,骨髓(BM)和循环单核细胞中会启动修复基因活化。为验证这个假设,作者广泛定义5个主要的细胞类群,并重点关注单核细胞。最后结果表明,修复基因在心脏招募前会在骨髓和循环单核细胞中被远程激活。
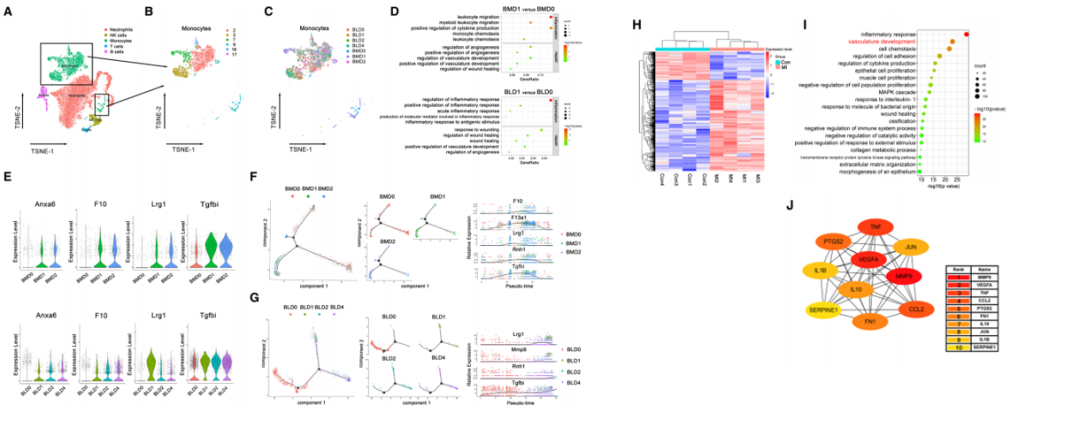
02 Step 2
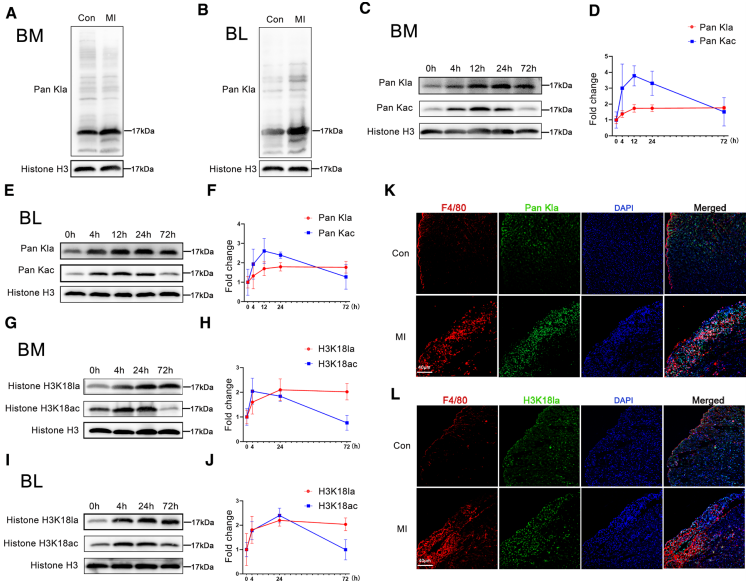
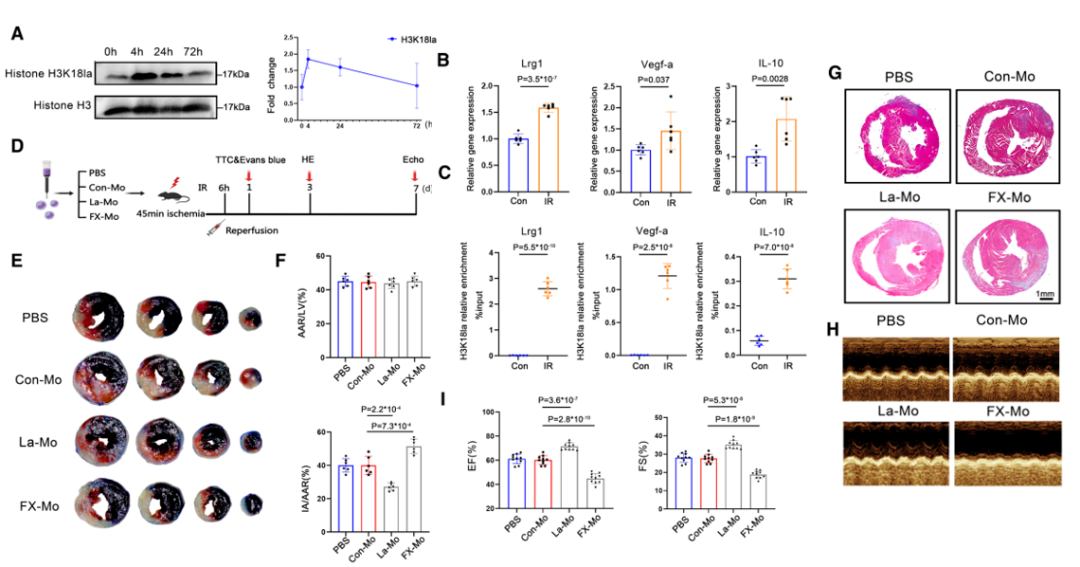
为了探讨乳酸化在心肌梗死后单核细胞修复基因的早期和远程激活中的作用,评估了心肌梗死早期心肌梗死中心肌和循环单核细胞以及心肌浸润巨噬细胞中乳酸化的变化。
结果显示,心肌梗死小鼠BM和循环单核细胞的整体乳酸化水平与对照组小鼠相比显著升高。心肌梗死后3天的免疫荧光染色显示心肌梗死区整体乳酸化和H3K18la水平显著升高,合并共聚焦图像显示,乳酸化定位于梗死区巨噬细胞的细胞核。
03 Step 3
H3K18Ia富集于启动子区域和基因上游区域,H3K18Ia和H3K18ac(乳酸化和乙酰化)显著增加。此外,基因集合富集分析显示,H3K18Ia调控的基因与血管生成和伤口愈合紧密相关。许多参与血管生成过程的代表基因(Vegf-a、Lrg1和IL-10,均为H3K18la修饰增多的基因)在MI后显著上调。
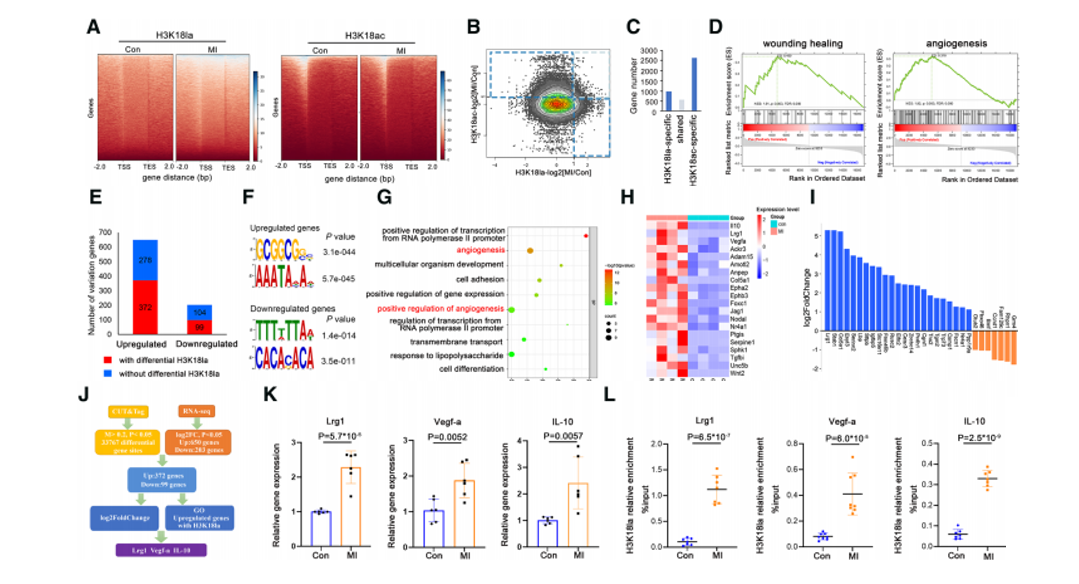
04 Step 4
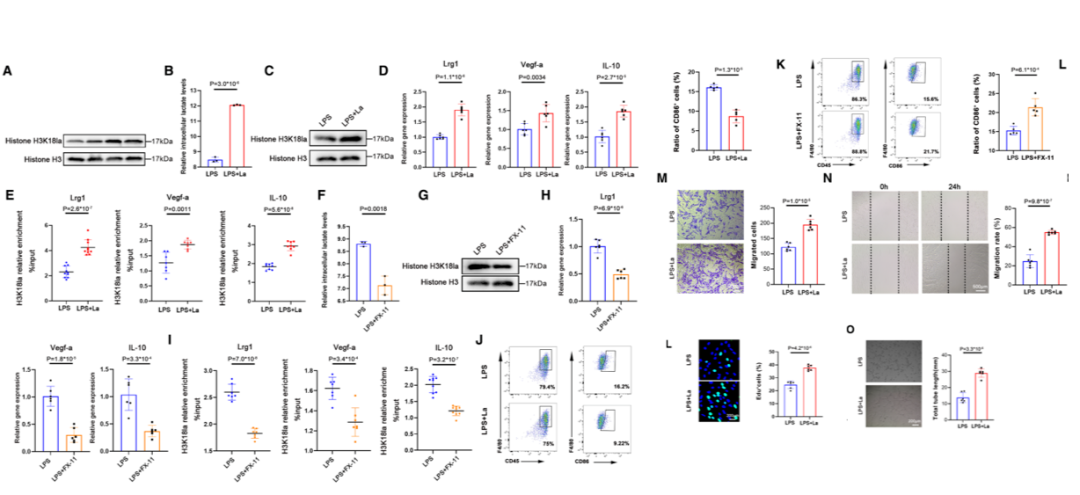
作者使用脂多糖刺激骨髓来源的巨噬细胞导致H3K18Ia水平显著升高。加入外源性乳酸盐后,细胞内乳酸水平和组蛋白H3K18la水平也明显升高,说明H3K18la调控巨噬细胞靶基因的转录和修复活性。
05 Step 5
为了评估组蛋白乳酸化对缺血性心脏免疫环境的影响,采用永久性冠状动脉左前降支结扎建立小鼠心肌梗死模型,并用乳酸钠或FX-11处理小鼠,以控制单核细胞组蛋白乳酸化。
结果显示,H3K18la改善了心肌梗死后的射血分数和缩短分数,表明H3K18la除了具有抗炎和促血管生成作用外,还改善了心肌梗死后的心功能障碍。
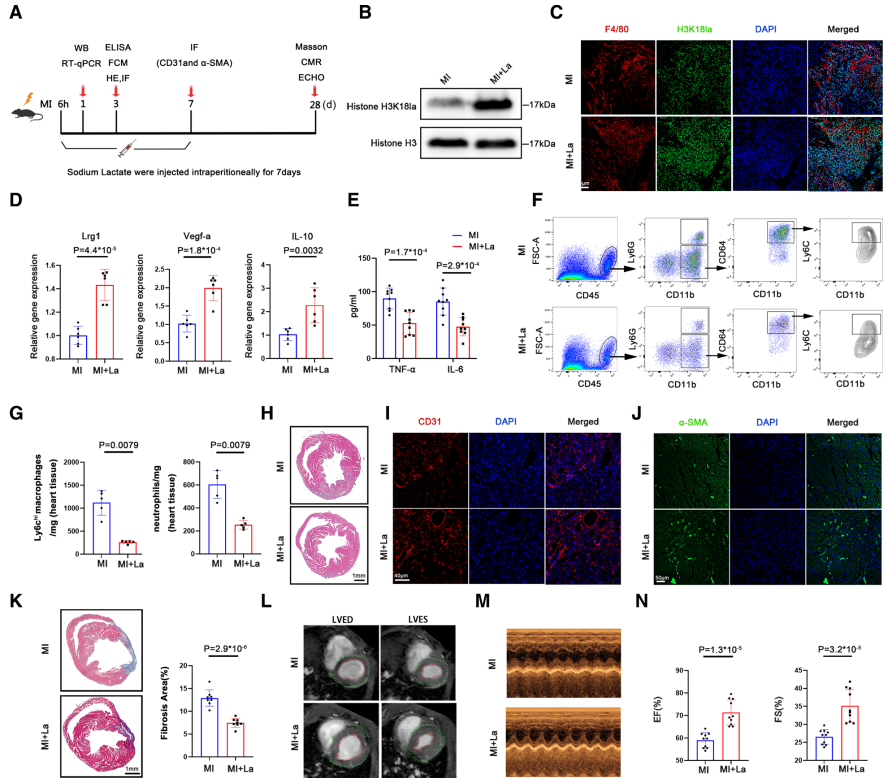
06 Step 6
采用乳酸钠治疗MI小鼠后结果显示,循环单核细胞和浸润巨噬细胞中,H3K18la水平显著增加,Lrg1、Vegf-a和IL=10的mRNA水平也显著增加,即心肌梗死后循环单核细胞内源性糖酵解重编程部分促进H3K18la水平上升。
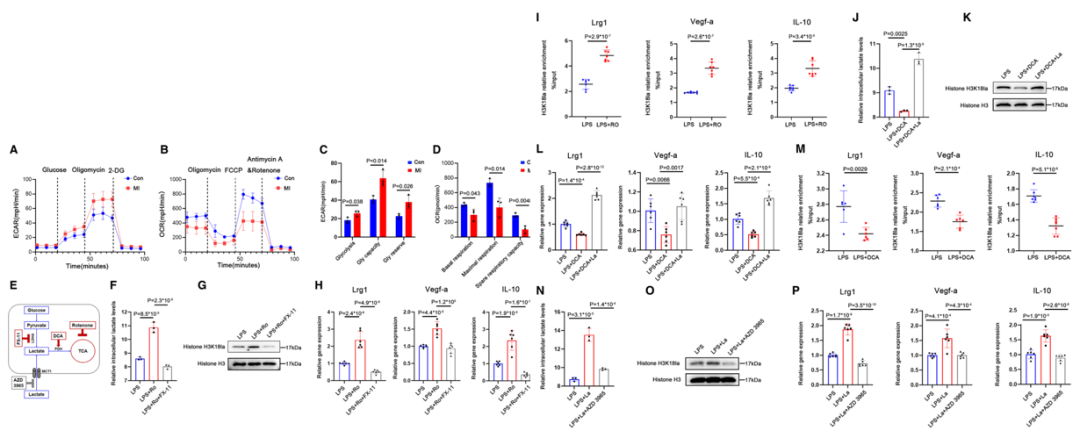
07 Step 7
作者基于分子对接研究评价H3K18la和P300/MOF/GCN5的不同结合方式,应用免疫沉淀反应来评估P300/MOF/GCN5和乳酸化组蛋白的相互结合能力。通过免疫荧光染色定位H3K18la和P300/MOF/GCN5。
最后,还进行了蛋白免疫印迹实验。实验结果显示,IL-1β以剂量依赖性的方式,刺激促进BMDM中H3K18la水平升高。IL-1β刺激促进GCN5和乳酸化蛋白相互结合以及H3K18la靶向基因的乳酸化和蛋白水平。
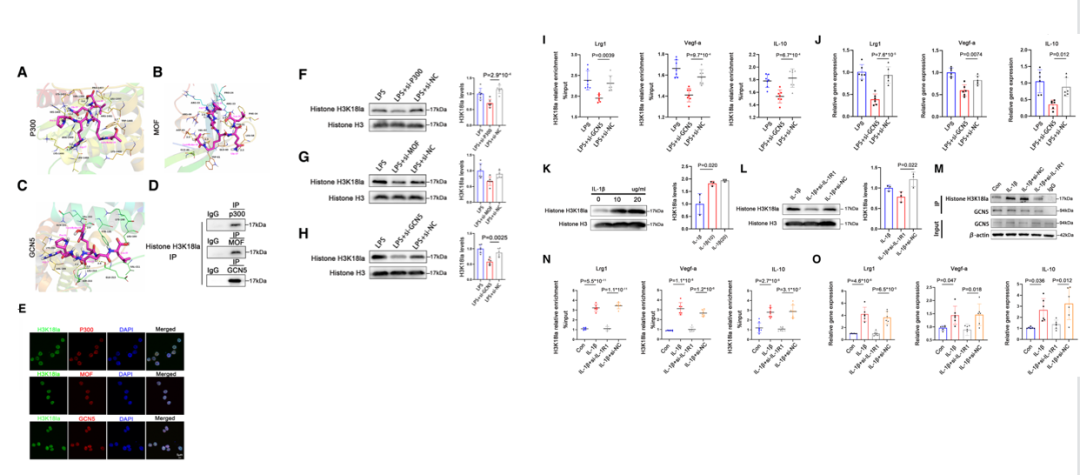
08 Step 8
最后,作者再次进行了免疫印迹实验,并发现组蛋白乳酸化有利于缺血再灌注后损伤中的心脏修复环境。
四、补充知识
01组蛋白修饰与疾病
目前已知的组蛋白翻译后修饰在不同人类疾病病理学中有不同的影响。

02组蛋白修饰与应用
下面这篇文章采用了ChIP assay、免疫组化、免疫荧光、qPCR、Transwell、Western Blot等实验方法。

研究背景:组蛋白去乙酰化酶(HDAC)是一种通过修饰组蛋白来调节基因表达的蛋白酶,在肿瘤中通常被异常激活。目前得到批准的泛HDAC抑制剂,在临床试验中仅观察到有限的乳腺癌治疗成功案例。尽管有报道称NEDD9与乳腺癌转移有关,但它并未受到太多关注,也没有开发出治疗策略。在本研究中,发现靶向NEDD9-FAK通路的泛HDAC抑制剂在临床前模型中加剧乳腺癌转移,这可能严重阻碍其治疗效果。
该文章最后证明了FAK抑制剂可以逆转通过泛HDAC抑制剂上调NEDD9诱导的乳腺癌转移,这可能为乳腺癌提供潜在的联合治疗。
文章出自:细胞实验外包 想了解更多请关注:http://www.dj-cro.com/